乾電池は、最も単純な形の発電源です。セルを組み合わせた多数のセルが一緒になってバッテリーを形成します。ザ・ 鉛酸 またはニッケルカドミウム 電池 乾電池の高度なバージョンです。このセルは、1866年にフランスのエンジニアGeorges Leclancheによって最初に発明されました。彼の発明は、彼の名前にちなんでLeclancheバッテリーと名付けられました。でも当時はとても重くて壊れやすいものでした。乾電池も同じ原理で、ルクランシェ電池の高度なバージョンであり、電圧とサイズが異なります。ルクランシェ電池の改良型であるマンガン乾電池の商用形態は、1881年にマインツのカールガスナーによって発明されました。大量に生産され、おもちゃ、ラジオ、電卓などの多くのアプリケーションで使用されています。
乾電池とは?
乾電池は、化学反応に基づいて電気を生成する装置です。セルの2つの電極が閉じたパスを介して接続されている場合、セルは電子を一方の端からもう一方の端に強制的に流します。電子の流れにより、閉回路に電流が流れます。

乾電池層
化学反応の助けを借りて、電子は一方の端からもう一方の端に流れます。正しい極性で接続された2つ以上のセルの場合、高電位のためにより多くの電子が流れます。この組み合わせはバッテリーと呼ばれます。 1.5Vから100Vの最小電圧まで、バッテリーを使用してさまざまな電圧を得ることができます。バッテリーの出力DC電圧でさえ、次のようなパワーエレクトロニクスコンバーターを使用してさまざまなレベルに調整できます。 チョッパー 回路。
細胞の構造
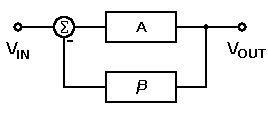
マンガン乾電池の構造を図に示します。それは亜鉛または一般的にグラファイトロッドとしてのアノード端子で構成されています。炭素はカソード端子を形成します。古いバージョンの乾電池では、亜鉛がカソードとして使用され、グラファイトがアノード端子として使用されていたことが観察される場合があります。元素の選択は、基本的に元素の最も外側の軌道の化学的構成に基づいています。

乾電池の構造
それが最も外側の軌道により多くの数の電子を持っている場合、それはドナーとして機能することができ、したがってカソードを形成します。同様に、最も外側の軌道の電子が少ない場合、それは容易に受け入れられ、したがってアノードを形成します。間に配置された電解質は、化学反応の触媒として機能します。一般的に、電解液には塩化アンモニウムゼリーを使用しています。示されている図では、使用される電解液は亜鉛と塩化物の混合物です。また、電解質として塩化ナトリウムも使用されています。二酸化マンガンと炭素の混合物が陽極棒の周りに囲まれています。
構成全体が金属管に配置されます。セル上部のピッチを使用することで、ゼリーの乾燥を防ぎます。下部にカーボンワッシャーを配置。このワッシャーの目的は、亜鉛陽極棒が容器に接触するのを防ぐことです。
これは、図に示すようにスペーサーとも呼ばれます。亜鉛缶はまた、断熱のために紙の断熱材で囲まれています。大型バッテリーには、マイカなどの他の絶縁材料も使用されます。エルのプラス端子は上部に形成されています。セルの負の端子はベースに形成されます。
乾電池の働き
乾電池は基本的に化学反応に作用します。電解質と電極の間で起こる反応により、電子は一方の電極からもう一方の電極に流れます。酸などの物質は水に溶解してイオン化粒子を形成します。イオン化粒子には2つのタイプがあります。正イオンは陽イオンと呼ばれ、負イオンは陰イオンと呼ばれます。水に溶ける酸は電解質と呼ばれます。
上記の図では、電解質として塩化亜鉛が形成されています。同様に、塩化アンモニウムゼリーも電解質として形成されます。電解液に浸された金属棒が電極を形成します。金属棒の化学的性質に基づいて、陽極として正極、陰極として負極があります。
電極は反対に帯電したイオンをそれらの側に引き付けます。たとえば、カソードは陰イオンを引き付け、アノードは陽イオンを引き付けます。このプロセスでは、電子が一方向から別の方向に流れるため、電荷の流れが得られます。これは呼ばれます 電流 。
化学反応
セル内で発生する反応を以下に示します。最初は酸化反応です。

この場合、亜鉛カソードは正に帯電した亜鉛イオンに酸化され、2つのイオンを放出します。これらの電子はアノードによって収集されます。次に、還元反応が起こります。

アノードでの還元反応は上に示されています。この反応により電流が発生します。酸化マグネシウムとともに酸化物イオンを放出します。この反応は、マグネシウムが電解質と結合したときに形成されます。


“サイレンの作り方 ”
他の2つの反応は、乾電池で起こる酸塩基反応と沈殿反応を表しています。酸塩基反応では、NHがOHと結合して、水とともにNH3を生成します。結果はNH3と水ベースです。
乾電池と湿電池の違い
乾電池と湿電池の主な違いは、電解質の形態です。前に説明したように、乾電池では、塩化アンモニウムなどの電解質は本質的に乾燥しています。このような乾電池はより一般的で、おもちゃやラジオなどで使用されます。しかし、湿電池では、電解質は液体状態です。
危険な腐食性液体である硫酸などの液体電解質が使用されています。このような液体の性質上、湿電池は本質的に爆発性が高く、注意して取り扱う必要があります。このようなウェットセルの最大の利点は、簡単に再充電してさまざまな用途に使用できることです。このようなバッテリーは、航空、ユーティリティ、エネルギー貯蔵、および携帯電話の塔で一般的に使用されています。
乾電池の機能
乾電池は、電極と電解質の間の化学反応に基づいて機能します。電極が電解質に配置されると、反対に帯電したイオンが電極に引き付けられます。これにより電荷が流れ、電流が発生します。
利点
ザ・ 乾電池の利点 以下のものが含まれます。
- 乾電池には、次のような多くの利点があります。
- サイズが小さいです。
- さまざまな電圧レベルがあります。
- それは便利で、多くのアプリケーションがあります。
- それはDC電圧の唯一の源です。
- パワーエレクトロニクス回路と併用して、出力電圧を調整できます。
- 充電式です。
短所
ザ・ 乾電池の欠点 以下のものが含まれます。
- 注意して取り扱う必要があります
- 爆発性です
- 定格の大きいバッテリーは非常に重い
アプリケーション
ザ・ 乾電池の用途 以下のものが含まれます。
- おもちゃ
- 航空
- 携帯電話
- 無線
- 電卓
- 時計
- 補聴器
したがって、の操作、分類、およびアプリケーションを見てきました。 乾電池 。注意すべき興味深い点の1つは、電極が物理的に接触している場合にのみバッテリーが機能することです。 2つの電極間に導電性媒体が存在する必要があります。問題は、水を乾電池の電極間の導電性媒体として使用できるかどうかです。その場合、このセルを水に浸すとどうなりますか?




![イオン検出回路 [静電気放電検出器]](https://electronics.jf-parede.pt/img/sensors-and-detectors/09/ion-detector-circuit-static-discharge-detector-1.jpg)